BLOQUE 3
5/12/2014
Enlaces intermoleculares
Son los que mantienen unidas entre sí las moléculas de una misma sustancia.Los enlaces intermoleculares se dan entre moléculas, básicamente consisten en interacciones dipolo-dipolo, debidas a la polaridad de las moléculas. Los dos enlaces que existen son los puentes de hidrógeno y las fuerzas de Van der Waals.
La interacción dipolo-dipolo consiste en la atracción electrostática entre el extremo positivo de una molécula polar y el negativo de otra. El enlace de hidrógeno es un tipo especial de interacción dipolo-dipolo.
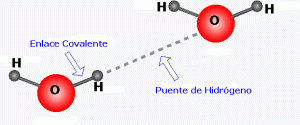
Puentes de hidrógeno
Se da en las moléculas que tienen hidrógeno unido a un átomo muy electronegativo y pequeño (F, O, N). El átomo unido al hidrógeno atrae los electrones apareciendo una alta densidad de carga negativa sobre él y positiva sobre el hidrógeno, lo que hace que las moléculas puedan unirse por atracción electrostática. Los compuestos con este tipo de enlace presentan elevados puntos de fusión y ebullición, comparados con compuestos semejantes en los que no se producen estas fuerzas entre sus moléculas.
Fuerzas de Van der Waals
Son fuerzas de tipo electrostático que se producen entre moléculas polares y también entre moléculas apolares. En el primer caso, los dipolos existentes interaccionan entre sí dando lugar a uniones débiles entre ellos.
3/12/2014
2/12/2014
31/11/2014
Enlace iónico: Se puede observar como se transfieren los electrones del menos electronegativo al más electronegativo para conseguir la configuración de gas noble.
Enlace covalente: Los átomos del enlace covalente forman moléculas compartiendo electrones para conseguir una estructura estable.
Enlace metálico: Se comparten de forma generalizada los electrones de la última capa de valencia y se los átomos se vuelven cationes.
24/11/2014
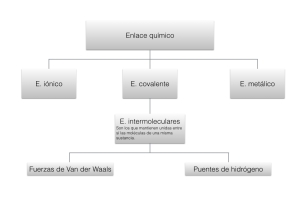
Enlaces químicos
Los átomos tienden a unirse unos a otros para formar entidades más complejas. De esta manera se construyen todas las sustancias. el enlace químico son las fuerzas que mantienen unidos a átomos moléculas o iones de forma estable. Existen tres tipos de enlace:
- Enlace iónico
- Enlace covalente
- Enlace metálico
También existen enlaces intermoleculares que son los que mantienen unidas entre sí las moléculas de una misma sustancia. Entre ellos existen los siguientes dos tipos:
- Puentes de hidrógeno
- Fuerzas de Van der Waals
La causa determinante de que los átomos traten de combinarse con otros es la tendencia de todos ellos a adquirir la configuración de gas noble en su capa mas externa o «capa de valencia».
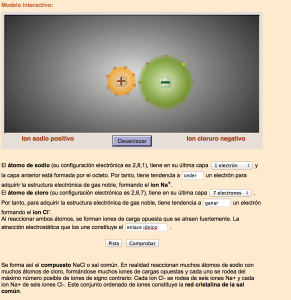
Enlace iónico
Si enfrentamos un átomo al que le falten pocos electrones en su capa de valencia para adquirir la configuración de gas noble (muy electronegativo), con otro cuya electronegatividad sea baja, el más electronegativo conseguirá electrones y el otro los perderá, para así conseguir la configuración de octete.
Este enlace tendrá lugar entre metales y no metales. En los compuestos iónicos no se puede hablar de moléculas individuales, sino de grandes agregados de iones denominados redes cristalinas. La red cristalina es la forma sólida de cómo se ordenan y empaquetan los átomos, moléculas, o iones. Estos son empaquetados de manera ordenada y con patrones de repetición que se extienden en las tres dimensiones del espacio.
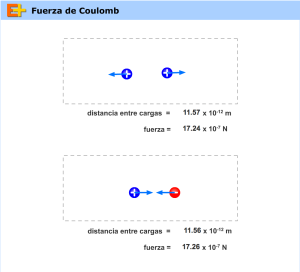
Ley de Coulomb
Las fuerzas colombianas son las fuerzas de atracción o de repulsión entre dos cargas y se rigen por la ley de coulomb que establece: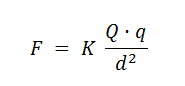
La Intensidad de la fuerza de atracción o de repulsión entre 2 cargas es directamente proporcional al, producto de las cargas e inversamente proporcional al cuadrado de la distancia que las separa.
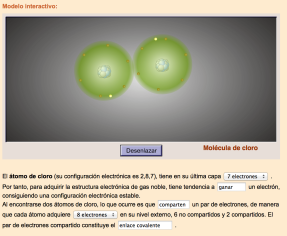
enlace covalente
Si los átomos que se enfrentan son ambos electronegativos (no metales), ninguno de los dos cederá electrones. Una manera de adquirir la configuración de gas noble en su última capa es permanecer juntos con el fin de compartir electrones.
El proceso fundamental de este tipo de enlace es la compartición de electrones. Es un enlace característico entre átomos de electronegatividad alta.
Cuando los átomos se unen mediante este tipo de enlace se forma unas nuevas entidades integradas por los átomos unidos: las moléculas.
enlace metálico
El enlace metálico es la unión de átomos metálicos en una disposición muy ordenada y compacta de iones positivos del metal (red metálica) entre los cuales se distribuyen los electrones perdidos por cada átomo a modo de «nube electrónica». Se origina así una red cristalina.
El modelo se basa en una de las propiedades características de los metales: su baja electronegatividad. Es importante observar que los electrones pueden circular libremente entre los cationes, no están ligados a los núcleos y son compartidos por todos ellos.
En el siguiente video podemos ver la estructura cristalina y el enlace metálico.
BLOQUE 2
9/11/2014
Tabla Periódica de los elementos
BLOQUE 1
7/11/2014
El modelo atómico actual
Fué desarrollado durante la decada de 1920, sobre todo por Schrödinger y Heisenberg. Es un modelo de gran complejidad matemática, tanta que usándolo sólo se puede resolver con exactitud el átomo de hidrógeno.
De cualquier modo, el modelo atómico mecano-cuántico encaja muy bien con las observaciones experimentales.
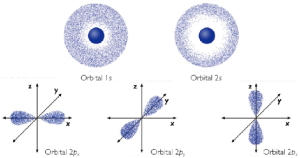
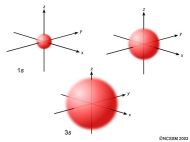
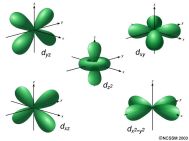
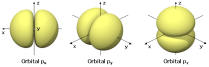
De este modelo dire que no se habla de órbitas, sino de orbitales. Un orbital es una región del espacio en la que la probabilidad de encontrar al electrón es máxima. Los orbitales atómicos tienen distintas formas geométricas.
La nueva teoría considera que los electrones están distribuidos en torno al núcleo en niveles energéticos, que vienen dados por el número cuántico principal n. Valores de n=1, 2, 3, 4… El número de capas o niveles energéticos que poseen los átomos de un elemento viene dado por el número del periodo en que está situado en la tabla periódica.
Dentro de cada nivel hay subniveles energéticos, que vienen definidos por el número cuántico secundario l. Los valores que puede tomar son desde 0 hasta n-1. El número cuántico l indica el subnivel energético dentro de cada nivel y el tipo de orbital de cada subnivel. Por eso hay disitintos tipos de orbitales dentro de cada subnivel. Tipos:
5/11/2014
Nucleos atómicos
El núcleo atómico es la parte central de un átomo y tiene carga positiva. Está formado por protones y neutrones (denominados nucleones) que se mantienen unidos por medio de la interacción nuclear fuerte, la cual permite que el núcleo sea estable, a pesar de que los protones se repelen entre sí (como los polos iguales de dos imanes).
La existencia del núcleo atómico fue deducida del experimento de Rutherford, donde se bombardeó una lámina fina de oro con partículas alfa, que son núcleos atómicos de helio emitidos por rocas radiactivas. La mayoría de esas partículas traspasaban la lámina, pero algunas rebotaban, lo cual demostró la existencia de un minúsculo núcleo atómico.
Nº atómico (Z): determina el elemento químico al que pertenece, es el número de protones.
Nº másico (A): nos indica el número de protones y neutrones que hay en un átomo (el número de protones y neutrones no tiene por qué ser el mismo).
Isótopo:Son los átomos (de un mismo elemento) que difieren en el número de protones y neutrones.
Ión: es una partícula cargada eléctricamente constituida por un átomo o molécula que no es eléctricamente neutra. Conceptualmente esto se puede entender como que, a partir de un estado neutro de un átomo o partícula, se han ganado o perdido electrones; este fenómeno se conoce como ionización. Existen dos tipos de iones dependiendo de su carga:
- Cationes: Carga positiva. Ha perdido electrones, por tanto tiene más protones que electrones. X-ne- → x+n
- Aniones: Carga negativa. Ha ganado electrones, por tanto tiene más electrones que protones. X+ne- →x-n
Masa atómica: se conoce como masa atómica a la masa que posee un átomo mientras éste permanece en reposo. En otras palabras, puede decirse que la masa atómica es aquella que surge de la totalidad de masa de los protones y neutrones pertenecientes a un único átomo en estado de reposo. Dentro del Sistema Internacional, la unidad que permite calcularla y reflejarla es la masa atómica unificada.
El espín (del inglés spin ‘giro, girar’) o momento angular intrínseco se refiere a una propiedad física de las partículas subatómicas, por la cual toda partícula elemental tiene un momento angular intrínseco de valor fijo. Se trata de una propiedad intrínseca de la partícula como lo es la masa o la carga eléctrica. El espín fue introducido en 1925 por Ralph Kronig e, independientemente, por George Uhlenbeck y Samuel Goudsmit.
12/10/2014
Thomson
¿ En qué consiste el modelo atómico de Thomson?
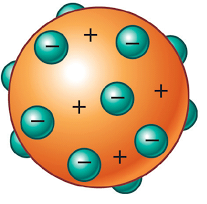
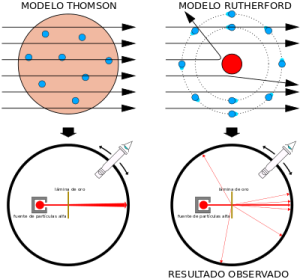
J.J. Thomson supuso que, como los átomos tenían una masa mucho mayor que la de los electrones (1840 veces mayor), la carga positiva debía ocupar mucho más espacio. Así pues, según Thomson, el átomo debía ser como una gran masa de carga positiva, e insertados en ella, debían estar los electrones. La carga negativa de los electrones compensaba la carga positiva, para que el átomo fuera neutro.
LOS EXPERIMENTOS DE THOMSON
Thomson realizó varios experimentos usando rayos catódicos, esos que encontrábamos hasta hace pocos años dentro de nuestros televisores y le condujeron al descubrimiento de los electrones. Pues bien, en su tercer experimento a finales del siglo XIX determinó la relación entre la carga y la masa de los rayos catódicos, al medir cuánto se desvían por un campo magnético y la cantidad de energía que llevan. Encontró que la relación carga/masa era más de un millar de veces superior a la del ion Hidrógeno, lo que sugiere que las partículas son muy livianas o muy cargadas.
Las conclusiones de Thomson fueron audaces: los rayos catódicos estaban hechos de partículas que llamó «corpúsculos», y estos corpúsculos procedían de dentro de los átomos de los electrodos, lo que significa que los átomos son, de hecho, divisibles. Thomson imaginó que el átomo se compone de estos corpúsculos en un mar lleno de carga positiva; a este modelo del átomo, atribuido a Thomson, se le llamó el modelo de pudín de pasas.
Thomson imaginó el átomo como una especie de esfera positiva continua en la que se encuentran incrustados los electrones, más o menos como las pasas
Este experimento sobre los rayos catódicos en campos magnéticos y eléctricos dieron pie al descubrimiento del electrón he hizo posible medir la relación entre su carga y su masa.
Fallos del modelo. Cómo se descubrieron: Descripción del experimento
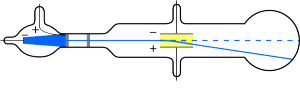
El fallo de este modelo es que no contemplaba la existencia del núcleo. Las distribución de la carga positiva era errónea loss electrones no están situados en el núcleo sino que están en continuo movimiento en la corteza. Este modelo fue rechazado después de que Rutherford hiciera el experimento de la lámina de oro.
Este experimento consistió en mandar un haz de partículas alfa sobre una fina lámina de oro y observar cómo dicha lámina afectaba a la trayectoria de dichos rayos. Según el modelo de Thomson, las partículas alfa atravesarían la lámina metálica sin desviarse demasiado de su trayectoria, pero se observó que un pequeño porcentaje de partículas se desviaban. Rutherford concluyó que el hecho de que la mayoría de las partículas atravesaran la hoja metálica, indica que gran parte del átomo está vacío, que la desviación de las partículas alfa indica que las partículas poseen carga positiva, pues la desviación siempre es dispersa. Y el rebote de las partículas alfa indica un encuentro directo con una zona fuertemente positiva del átomo y a la vez muy densa.
El modelo atómico de Rutherford mantenía el planteamiento de Thomson, de que los átomos poseen electrones, pero su explicación sostenía que todo átomo estaba formado por un núcleo y una corteza. El núcleo debía tener carga positiva, un radio muy pequeño y en él se concentraba casi toda la masa del átomo. La corteza estaría formada por una nube de electrones que orbitan alrededor del núcleo